অ্যাভোগাড্রোর সূত্রটি অ্যাভোগাড্রোর নীতি বা অ্যাভোগাড্রোর অনুমান নামেও পরিচিত। ইতালীয় বিজ্ঞানী আমেদিও কার্লো অ্যাভোগাড্রো এই সূত্রের প্রবক্তা। তার মত অনুসারে- একই তাপমাত্রা ও একই চাপে সম আয়তনের সকল গ্যাসে অনু সংখ্যা সমান থাকে।
অর্থাৎ একই তাপমাত্রা ও চাপে সমান আয়তনের সকল গ্যাসের অনু সংখ্যা একই।
অ্যাভোগাড্রো সূত্রের ব্যাখ্যা
এই প্রকল্পের মূল ধারণা হলো-
- স্থীর তাপমাত্রা ও চাপে সম আয়তনের মৌলিক ও যৌগিক সকল গ্যাসের মধ্যে সমান সংখ্যক অনু থাকে।
- একটি আদর্শ গ্যাসের নির্দিষ্ট ভরের জন্য তাপমাত্রা এবং চাপ স্থির থাকলে গ্যাসের আয়তন এবং পরিমাণ অর্থাৎ মোল সমানুপাতিক হয়।
- এই সূত্র থেকে দুটি অনুসিদ্ধান্ত পাওয়া যায়-
নিষ্ক্রিয় গ্যাস ছাড়া অন্য সকল মৌলিক গ্যাসের অনু দ্বীপরমাণুক এবং কোন গ্যাসে আণবিক ভর তার বাষ্প ঘনত্বের দ্বিগুণ।
উদাহরণ
অ্যাভোগাড্র প্রকল্প অনুসারে একই চাপ ও উষ্ণতায় X লিটার অক্সিজেনে যদি n সংখ্যক অক্সিজেন অনু থাকে তবে X লিটার ক্লোরিন গ্যাসেও n সংখ্যক ক্লোরিন অনু থাকবে।
একটি পদার্থের 1 গ্রাম মোল কোন সংখ্যা নির্দিষ্ট থাকে আমরা গ্রাম আণবিক ওজন হিসাবে উল্লেখ করি। 1 গ্রাম মোলে অনুর সংখ্যা 6.023 x 1023। এই 6.023 x 1023 কেই বলা হয় অ্যাভোগাড্রো সংখ্যা বা অ্যাভোগাড্রো ধ্রুবক (Na)
1 গ্রাম মোল গ্যাসের আয়তন আদর্শ তাপমাত্রা ও চাপে ( 0°C ও 1 বায়ুমণ্ডলীয় চাপ) 22.4 লিটার যা সমস্ত গ্যাসের জন্য একই।
অর্থাৎ আদর্শ তাপমাত্রা ও চাপে 22.4 লিটার পরিমাণ গ্যাসে অনুর সংখ্যা 6.023 x 1023
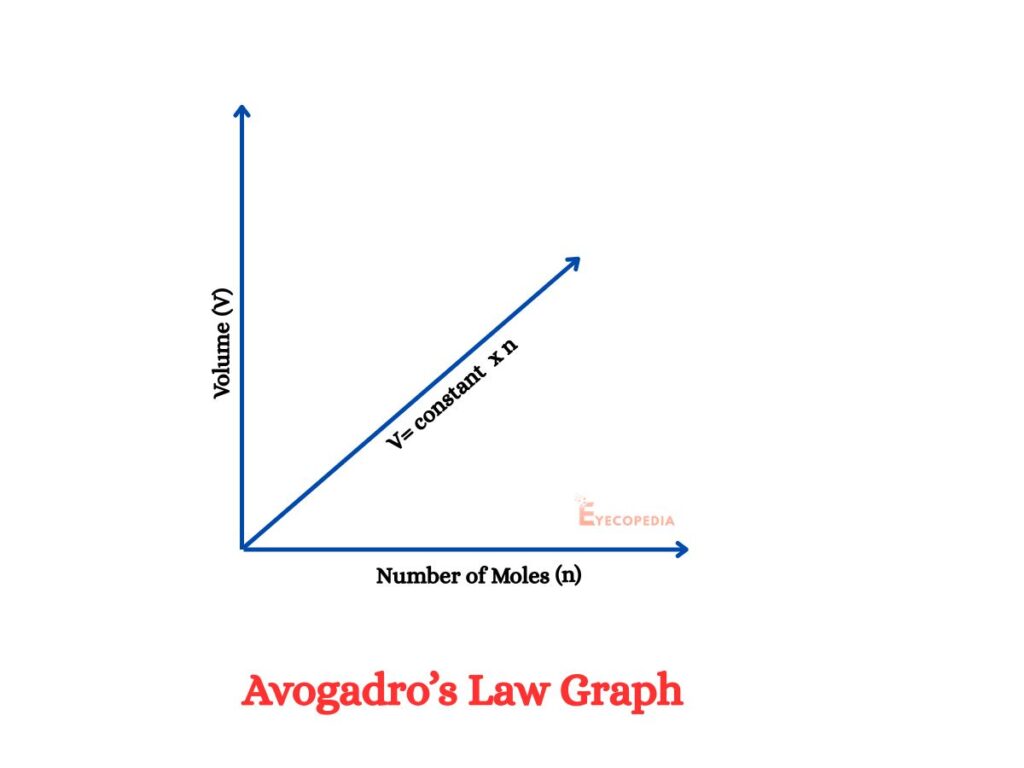
অ্যাভোগাড্রো সূত্রের গাণিতিক রূপ
V ∝ n or V/n = k
V হল গ্যাসের আয়তন
n হল গ্যাসীয় পদার্থের পরিমাণ
k হল একটি ধ্রুবক
গ্যাসীয় পদার্থের পরিমাণ বৃদ্ধি করা হলে গ্যাসের আয়তন বৃদ্ধি পায়।
- বলা যেতে পারে V1/n1 = V2/n2 = k
এই সমীকরণটি 2 টি ভিন্ন অবস্থার জন্য অ্যাভোগাড্রোর সূত্রকে প্রকাশ করে। যদি দুটি ভিন্ন অবস্থায় (যখন গ্যাসের আয়তন V1 এবং V2 এবং মোলের সংখ্যা n1 ও n2) তাপমাত্রা ও চাপ একই থাকে তবে এই সম্পর্কটি প্রযোজ্য।
অ্যাভোগাড্রো সূত্রের প্রয়োগ
i) গ্যাসের আয়তন ও মোলের সম্পর্ক জানা যায়।
ii) অ্যাভোগাড্রো সুত্রে রাসায়নিক বিক্রিয়ার অনুপাত জানতে সাহায্য করে।
iii) প্রাণীদের শ্বাস-প্রশ্বাস এই সূত্রের একটি ব্যবহারিক প্রয়োগ।
iv) অ্যাভোগাড্রোর পত্র আদর্শ গ্যাসের আচরণকে ব্যাখ্যা করে।
অ্যাভোগাড্রোর প্রকল্পকে সূত্র বলার তাৎপর্য
কোন বৈজ্ঞানিক ঘটনা কে সুনির্দিষ্ট ধারণা ও কল্পনার মাধ্যমে প্রকাশ করা হলে তাকে প্রকল্প বলা হয়। কোন প্রকল্প যখন পরীক্ষালব্ধ প্রমাণের মাধ্যমে সত্যতা যাচাই করা হয় তখন তাকে সূত্র বলে।
প্রকল্পের বাস্তবের সাথে মিল থাকতেও পারে আবার নাও থাকতে পারে।
এখন অ্যাভোগাড্রোর প্রকল্পকে সূত্র বলার কারণ হলো এই প্রকল্পের বিরুদ্ধে যেমন প্রমাণ মেলেনি আবার পুরোপুরি সত্য বলেও প্রমাণিত হয়নি।
0°C তাপমাত্রায় ও 1 বায়ুমণ্ডলীয় চাপে অ্যাভোগাড্রো প্রকল্পটিকে সত্য বলে প্রমাণ করা যায়।
তাই অ্যাভোগাড্রোর প্রকল্পকে সূত্র বলা যায়।